瑞博生物港交所递表 六款自研siRNA药物处于临床试验阶段
财经4月27日讯 日前,苏州瑞博生物技术股份有限公司(“瑞博生物”或“公司”正式向香港联交所递交A1上市申请表。
资料显示,瑞博生物成立于2007年,专注于RNA干扰(RNAi技术开发及小核酸药物产业化,是全球最早布局该领域的开拓者之一。在过往发展历程中公司已获得君联资本、国投创新、国风投、磐霖资本等多家知名机构的战略投资。
继小分子和抗体类药物之后,小核酸药物作为全新的治疗范式,正在形成现代制药的第三次浪潮,全球已有超20款小核酸药物获批上市。根据弗若斯特沙利文数据,全球小核酸药物市场从2019年的27亿美元增长到2023年的46亿美元,复合年增长率为14.3%。在技术持续进步、上市批准及临床验证不断增加的推动下,预计全球小核酸药物市场规模将加速增长,至2033年可达到467亿美元。
其中小干扰核酸(siRNA药物是核酸制药中最具颠覆性的方向,有望突破创新药产业研发中传统的研发“高风险”模式。一方面siRNA技术可以将临床研发成功率从传统药物的不足10%跃升至60%以上。另一方面,可以显著缩短研发周期,从靶点确定到临床申报仅需20-24个月。此外,对于许多慢性疾病患者来说,siRNA 药物超长效作用机制使得单次给药即可维持6-12个月疗效,极大地提高了治疗效果和患者的依从性。
国际上布局siRNA疗法的企业主要有Alnylam、Arrowhead、Novartis、Novo Nordisk等,而此次递表港交所的瑞博生物是在中国拥有临床阶段资产最多的小核酸制药公司,通过自主创新建立了丰富的siRNA药物管线,覆盖了心血管、代谢、肾病,肝病等多个疾病尤其是慢病治疗领域。
目前慢病治疗市场患者需求仍存在巨大未满足空间,以小核酸药物为代表的长效治疗方案被视为慢病领域新的突破口。
根据招股书,瑞博生物目前有六款自研siRNA药物处于临床试验阶段,涉及七种适应症,其中四款进入2期临床试验;另有超过20个临床前资产持续推进中。公司在心血管、代谢类和肾脏疾病的核心产品RBD4059在全球同类产品中首个推进到临床且进展最快(First-In-Modality,关键产品RBD5044具有Best-In-Class潜力;关键产品RBD1016在肝病领域中将作为乙型肝炎病毒联合治疗的支柱疗法,是实现功能性治愈的关键。其他在研管线亦有多款具全球领先的FIC或BIC潜力。
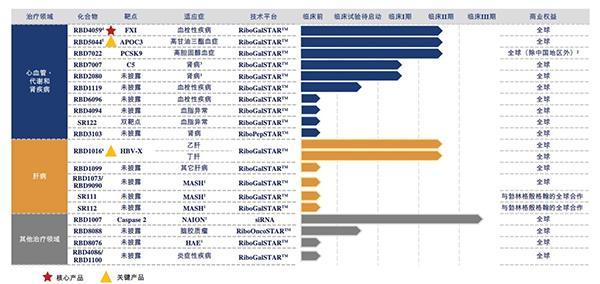
据了解,瑞博生物核心产品RBD4059是全球首个用于治疗血栓性疾病且临床开发进展最快的siRNA药物,处于临床试验2期阶段。RBD4059通过抑制FXI和阻断内源性凝血途径的激活从而实现其抗凝血/抗血栓的作用,不仅有望成为更有效的抗血栓治疗方法,且具有出血风险小的优势,其长效性还可实现低频率给药以提高患者依从性,将成为广大血栓性疾病患者的最佳治疗选择。
在高血脂领域,瑞博生物关键在研产品RBD5044是全球第二个进入临床开发的靶向APOC3的siRNA药物,在治疗高甘油三酯血症的同类siRNA候选药物具有最佳的潜力(Best-In-Class。截至2024年12月31日,全球尚未有任何一款批准治疗高甘油三酯血症的APOC3靶向疗法。RBD5044凭借siRNA 疗法低频率给药并药效持久的特性,相较每日用药的范式,有望为患者提供更便捷的治疗选择。
此外,瑞博生物RBD7022是全球第二个进入临床开发,同样也是有前景的治疗高胆固醇血症的PCSK9靶向siRNA。
公司另一款关键在研产品RBD1016是一种治疗慢性乙型肝炎的siRNA候选药物,是未来实现乙肝功能性治愈的联合方法的重要支柱疗法。RBD1016的1期临床试验结果已经证实,单次给药后HBsAg持续降低,显示良好的安全性和耐受性。RBD1016临床2a期试验已于2024年11月已完成全部临床试验患者入组。截止目前,全球尚未批准任何siRNA药物用于治疗慢性乙型肝炎。
据了解,瑞博生物作为国内最早专注小核酸药物开发的企业之一,截至2024年12月31日,已在中国、欧盟、美国及日本等主要司法管辖区共有458项专利,包括229项已批准专利和229项正在申请中专利,涉及小核酸序列、化学修饰、靶向递送技术、联合疗法和临床应用等,是全球拥有专利数量最多的小核酸药企之一。
瑞博生物表示,目前公司在全球小核酸制药赛道上已经构筑起独特的竞争壁垒,正加速向全球化生物制药领军企业迈进。
